量身定制
拒绝模板 定制风格
5.1 工艺布局
5.1.1 工艺布局应符合生产工艺流程及空气洁净度等级的要求,并应根据工艺设备安装和维修、管线布置、气流流型以及净化空凋系统等各种技术措施的要求综合确定。
5.1.2 工艺布局应防止人流和物流之间的交叉污染,并应符合下列基本要求:
1 应分别设置人员和物料进出生产区域的出入口。对在生产过程中易造成污染的物料应设置专用出入口。
2 应分别设置人员和物料进入医药洁净室(区)前的净化用室和设施。
3 医药洁净室(区)内工艺设备和设施的设置,应符合生产工艺要求。生产和储存的区域不得用作非本区域内工作人员的通道。
4 输送人员和物料的电梯宜分开设置。电梯不应设置在医药洁净室内。需设置在医药洁净区的电梯,应采取确保医药洁净区空气洁净度等级要求的措施。
5 医药工业洁净厂房内物料传递路线宜短。
5.1.3 在符合工艺条件的前提下,医药工业洁净厂房内各种固定技术设施的布置,应根据净化空气凋节系统的要求综合协调。
5.1.4 医药洁净室(区)的布置,应符合下列要求:
1 在满足生产工艺和噪声级要求的前提下,空气洁净度等级高的医药洁净室(区)宜靠近空气调节机房布置,空气洁净度等级相同的工序和医药洁净室(区)的布置宜相对集中。
2 不同空气洁净度等级医药洁净室(区)之间的人员出入和物料传送,应有防止污染措施。
5.1.5 医药工业洁净厂房内,宜靠近生产区设置与生产规模相适应的原辅物料、半成品和成品存放区域。 存放区域内宜设置待验区和合格品区,也可采取控制物料待检和合格状态的措施。不合格品应设置专区存放。
5.1.6 青霉素类等高致敏性药品的生产厂房应独立设置。避孕药品、卡介苗、结核菌素的生产厂房必须与其他药品的生产厂房分开设置。
5.1.7 下列药品生产区之间,必须分开布置:
1 β-内酰胺结构类药品生产区与其他生产区。
2 中药材的前处理、提取和浓缩等生产区与其制剂生产区。
3 动物脏器、组织的洗涤或处理等生产区与其制剂生产区。
4 含不同核素的放射性药品的生产区。
5.1.8 下列生物制品的原料和成品,不得同时在同一生产区内加工和灌装:
1 生产用菌毒种与非生产用菌毒种。
2 生产用细胞与非生产用细胞。
3 强毒制品与非强毒制品。
4 死毒制品与活毒制品。
5 脱毒前制品与脱毒后制品。
6 活疫苗与灭活疫苗。
7 不同种类的人血液制品。
8 不同种类的预防制品。
5.1.9 生产辅助用室的布置和空气洁净度等级,应符合下列要求:
1 取样室宜设置在仓储区内,取样环境的空气洁净度等级应与使用被取样物料的医药洁净室(区)相同。无菌物料取样室应为无菌洁净室,取样环境的空气洁净度等级应与使用被取样物料的无菌操作环境相同,并应设置相应的物料和人员净化用室。
2 称量室宜设置布生产区内,称量室的空气洁净度等级应与使用被称量物料的医药洁净室(区)相同。
3 备料室宜靠近称量室布置,备料室的空气洁净度等级应与称量室相同。
4 设备、容器及工器具的清洗和清洗室的设置,应符合下列要求:
1)空气洁净度100级、10 000级医药洁净室(区)的设备、容器及工器具宜在本区域外清洗,其清洗室的空气洁净度等级不应低于100 000级。
2)如需在医药洁净区内清洗的设备、容器及工器具,其清洗室的空气洁净度等级应与该医药洁净区相同。
3)设备、容器及工器具洗涤后应干燥,并应在与使用该设备、容器及工器具的医药洁净室(区)相同的空气洁净度等级下存放。无菌洁净室(区)的设备、容器及工器具洗涤后应及时灭菌,灭菌后应在保持其无菌状态措施下存放。
5.1.10 医药洁净室(区)的清洁工具洗涤和存放室不宜设置在洁净区域内。如需设置在洁净区域内时,医药洁净室(区)的空气洁净度等级应与使用清洁工具的洁净室(区)相同。
无菌洁净区域内不应设置清洁工具洗涤和存放室。
5.1.11 洁净工作服洗涤、干燥和整理,应符合下列要求:
1 空气洁净度100 000级及以上的医药洁净室(区)的洁净工作服洗涤、干燥和整理室,其空气洁净度等级不应低于300 000级。
2 空气洁净度300 000级的医药洁净室(区)的洁净工作服可在清洁环境下洗涤和干燥。
3 不同空气洁净度等级的医药洁净室(区)内使用的工作服,应分别清洗和整理。
4 无菌工作服的洗涤和干燥设备宜专用。洗涤干燥后的无菌工作服应在空气洁净度100级单向流下整理,并应及时灭菌。
5.1.12 无菌洁净室的设置,应根据本规范第5.1.9、5.1.13条和附录A确定。
5.1.13 质量控制实验室的布置和空气洁净度等级,应符合下列规定:
1 检验、中药标本、留样观察以及其他各类实验室应与药品生产区分开设置。
2 各类实验室的设置,应符合下列要求:
1)阳性对照、无菌检查、微生物限度检查和抗生素微生物检定等实验室,以及放射性同位素检定室等应分开设置。
2)无菌检查室、微生物限度检查实验室应为无菌洁净室,其空气洁净度等级不应低于10 000级,并应设置相应的人员净化和物料净化设施。
3)抗生素微生物检定实验室和放射性同位素检定室的空气洁净度等级不宜低于100 000级。
3 有特殊要求的仪器应设置专门仪器室。
4 原料药中间产品质量检验对生产环境有影响时,其检验室不应设置在该生产区内。
5.1.14 下列情况的医药洁净室(区)应予以分隔:
1 生产的火灾危险性分类为甲、乙类与非甲、乙类生产区之间或有防火分隔要求时。
2 按药品生产工艺有分隔要求时。
3 生产联系少,且经常不同时使用的两个生产区域之间。
5.1.15 医药工业洁净厂房应设置防止昆虫和其他动物进入的设施。
5.2 人员净化
5.2.1 医药工业洁净厂房内人员净化用室和生活用室的设置,应符合下列要求:
1 人员净化用室应根据产品生产工艺和空气洁净度等级要求设置。不同空气洁净度等级的医药洁净室(区)的人员净化用室宜分别设置。空气洁净度等级相同的无菌洁净室(区)和非无菌洁净室(区),其人员净化用室应分别设置。
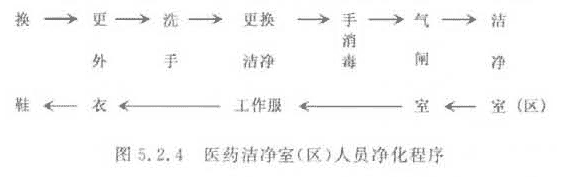
2 人员净化用室应设置换鞋、存外衣、盥洗、消毒、更换洁净工作服、气闸等设施。
3 厕所、淋浴室、休息室等生活用室可根据需要设置,但不得对医药洁净室(区)产生不良影响。
5.2.2 人员净化用室和生活用室的设计,应符合下列要求:
1 人员净化用室入口处,应设置净鞋设施。
2 存外衣和更换洁净工作服的设施应分别设置。
3 外衣存衣柜应按设计人数每人一柜设置。
4 人员净化用室的空气净化要求,应符合本规范第9.2.11条的规定。
5 盥洗室应设置洗手和消毒设施。
6 厕所和浴室不得设置在医药洁净区域内,宜设置在人员净化用室外。需设置在人员净化用室内的厕所应有前室。
7 医药洁净区域的入口处应设置气闸室;气闸室的出入门应采取防止同时被开启的措施。
8 青霉素等高致敏性药品、某些甾体药品、高活性药品及有毒害药品的人员净化用室,应采取防止有毒有害物质被人体带出人员净化用室的措施。
5.2.3 医药工业洁净厂房内人员净化用室和生活用室的面积,应根据不同空气洁净度等级和工作人员数量确定。
5.2.4 医药洁净室(区)的人员净化程序宜按图5.2.4布置。
5.3 物料净化
5.3.1 医药洁净室(区)的原辅物料、包装材料和其他物品出入口,应设置物料净化用室和设施。
5.3.2 进入无菌洁净室(区)的原辅物料、包装材料和其他物品,除应满足本规范第5.3.1条的规定外,尚应在出入口设置供物料、物品灭菌用的灭菌室和灭菌设施。
5.3.3 物料清洁室或灭菌室与医药洁净室(区)之间.应设置气闸室或传递柜。
5.3.4 传递柜密闭性应好,并应易于清洁。两边的传递门应有防止同时被开启的措施。传递柜的尺寸和结构,应满足传递物品的大小和重量所需要求。传送至无菌洁净室(区)的传递柜应设置相应的净化设施。
5.3.5 生产过程中产生的废弃物出口,宜单独设置专用传递设施,不宜与物料进口合用一个气闸室或传递柜。
5.4 工艺用水
5.4.1 饮用水的制备和使用,应符合下列要求:
1 饮用水的制备方式,应保证其水质符合现行国家标准《生活饮用水卫生标准》GB 5749的有关规定。
2 饮用水的储存和输送,应符合本规范第10.2.1和10.2.2条的规定。
5.4.2 纯化水的制备、储存和分配,应符合下列要求:
1 纯化水的制备方式,应保证其水质电阻率大于0.5MΩ·cm,并应符合现行《中华人民共和国药典》的纯化水标准的规定。
2 用于纯化水储罐和输送管道、管件等的材料,应无毒、耐腐蚀、易于消毒,并宜采用内壁抛光的优质不锈钢或其他不污染纯化水的材料。储罐的通气口应安装不脱落纤维的疏水性过滤器。
3 纯化水输送管道系统应采取循环方式。设计和安装时不应出现使水滞留和不易清洁的部位。循环的干管流速宜大于1.5m/s,不循环的支管长度不应大于管径的6倍。纯化水终端净化装置的设置应靠近使用点。
4 纯化水储罐和输送系统,应有清洗和消毒措施。
5.4.3 注射用水的制备、储存和使用,应符合下列要求:
1 注射用水的制备方式,应保证其水质符合现行《中华人民共和国药典》的注射用水标准的规定。
2 用于注射用水储罐和输送管道、管件等的材料,应无毒、耐腐蚀,并应采用内壁抛光的优质低碳不锈钢管或其他不污染注射用水的材料。储罐的通气口应安装不脱落纤维的疏水性除菌器。
3 注射用水的储存可采用65℃以上保温循环的方式,也可采用80℃以上或4℃以下保温的方式。循环时干管流速宜大于1.5m/s。
4 注射用水输送管道系统应采取循环方式。
5 注射用水输送管道系统设计和安装时,不应出现使水滞留和不易清洁的部位。使用点不循环支管长度不应大于管径的6倍。注射用水终端净化装置的设置应靠近使用点。
6 输送注射用水的不锈钢管道,应采用内壁无斑痕的对接氩弧焊焊接。需要拆洗的不锈钢管道宜采用卡箍式、法兰等优质低碳不锈钢卫生管件连接,法兰垫片材料宜采用聚四氟乙烯。不锈钢管道焊接后宜钝化。
7 注射用水储罐和输送系统,应设置在位清洗和在位灭菌设施。
5.4.4 医药洁净室(区)内工艺用水系统的验证,应符合附录C规定。

净化热线:
15000180527
邮箱:
15000546345@163.com
地址:
上海沈砖公路5666号临港科技城

免费量房

获取案例

免费报价
联 系 人:张先生
联系方式:15000180527
联系邮箱:15000546345@163.com
公司地址:上海沈砖公路5666号临港科技城
主要为浦东、闵行、松江、奉贤、金山、青浦、嘉兴、嘉善、苏州、无锡、南通等上海周边地区客户提供办公室净化、办公楼净化设计、厂房净化设计及工厂钢结构搭建,无尘净化车间装饰净化服务。